Explorarea biomarkerilor bolii Alzheimer: fabricarea de noi biomateriale functionale si dezvoltarea de biosenzori pentru diagnosticul timpuriu
Project Director: Dr. Adrian ENACHE
Cod proiect: PN-III-P4-ID-PCE-2020-1403
Director proiect: Adrian Enache
Tipul proiectului: National
Programul: Proiecte de cercetare exploratorie
Finantator: Unitatea Executiva pentru Finantarea Invatamantului Superior, a Cercetarii, Dezvoltarii si Inovarii, UEFISCDI
Contractor: Institutul National C-D pentru Fizica Materialelor
Status: In desfasurare
Data inceput: 4 ianuarie, 2021
Data sfarsit: 28 decembrie, 2023
Scopul acestui proiect de cercetare este de a contribui / stimula activitățile de CDI în domenii de interes social general, de a crește capacitatea sectorului public de cercetare și de a răspunde provocărilor globale care afectează economia română / UE prin implementarea cercetării științifice în domenii de chimie analitică, asistență medicală, biofizică și biochimie prin explorarea biomarkerilor specifici bolii Alzheimer. Proiectul se adreseaza dezvoltării (i) de noi biomaterialelor funcționale bazate pe funcționalizarea materialelor nanostructurate cu peptide Amiloid beta și (ii) a un biosenzor electrochimic pentru evaluarea activitatii enzimatice a peptidei Metionina sulfoxid reductază, enzimă legată de detectarea timpurie a bolii Alzheimer. Mai multe materiale nanostructurate vor fi fabricate și suprafețele lor vor fi modificate cu peptida Amiloid beta, în special secvențele a 40 sau 42 de aminoacizi. Aceste noi suprafețe vor fi testate, in vederea evaluarii proprietăților bioactive, folosind celule neuronale. Biosenzorul electrochimic pentru monitorizare, cuantificare și evaluare a activității enzimatice a Metionina sulfoxid reductază va fi dezvoltat pe suprafetele modificate ale electrozilor de carbon de unica folosinta. Implementarea cu succes a proiectului va genera metodologii pentru noi biomateriale avansate și va sprijini dezvoltarea unei noi generații de biomateriale funcționale și biosenzori ce ar putea fi transpuse la scară industrială
Dr. Adrian Enache
Dr. Madalina Maria Barsan
Dr. Victor Diculescu
Dr. Monica Enculescu
Dr. Alexandru Evangelidis
Dr. Mihaela Bacalum
Drd. Ricardo Leote
Drd. Melania Onea
Articole publicate:
- Melania Onea, Mihaela Bacalum, Andreea Luminita Radulescu, Mina Raileanu, Liviu Craciun, Tiberiu Relu Esanu, Teodor Adrian Enache, Electrochemical evaluation of proton beam radiation effect on the B16 cell culture, Sci Rep 12, 2261 (2022).
- Oprea D, Sanz CG, Barsan MM, Enache TA. PC-12 Cell Line as a Neuronal Cell Model for Biosensing Applications. Biosensors.; 12(7) 500 (2022).
- Bunea, M.-C.; Diculescu, V.-C.; Enculescu, M.; Oprea, D.; Enache, T.A. Influence of the Photodegradation of Azathioprine on DNA and Cells. J. Mol. Sci. 23, 14438 (2022)
- Sanz, C; Aldea, A; Oprea, D; Onea, M; Enache, A.T; Barsan, M.M.; Novel cells integrated biosensor based on superoxide dismutase on electrospun fiber scaffolds for the electrochemical screening of cellular stress, Biosens Bioelectron 220 114858 (2023)
- Mihaela Bunea, Constantin Oprescu, Teodor Adrian Enache, On the electrochemical oxidation of methionine residues of proteins, J. Electroanal. Chem, Volume 931, 15 February 2023, 117209
- Mihaela Beregoi, Teodor Adrian Enache, Daniela Oprea, Monica Enculescu, Iulia Corina Ciobotaru, Cristina Busuioc and Ionut Enculescu, PEDOT:PSS based electrospun nanofibres used as trigger for fibroblasts differentiation, Smart Mater. Struct. 33 015009
Cereri de brevete depuse:
- Teodor Adrian Enache, Daniela Bratu Oprea, Mihaela Cristina Bunea, Mihaela Beregoi, Procedeu de detecție a melaninei produsă de culturile celulare B16, A/2022/00283
- Teodor Adrian Enache, Daniela Bratu Oprea, Mihaela Cristina Bunea, Mihaela Beregoi, Monica Enculescu Substrat nanostructurat pentru creșterea și transplantarea culturilor celulare si procedeul de fabricare. A/2022/00284.
Conferințe:
- A. Enache, M.L. Onea, M. Bacalum, Cells Under Irradiation – Electrochemical Evaluation, XXVIth International Symposium on Bioelectrochemistry and Bioenergetics of the Bioelectrochemical Society, 10.05.21 – 15.05.21, Cluj, Romania
- Leote, C. Sanz, A. Aldea, M.M. Barsan, V.C. Diculescu, Flexible Bio(sensors) for Point-of-Care Biomedical Applications, 72nd Annual Meeting of the International Society of Electrochemistry, 29.08.21 – 03.09.21, Jeju, Coreea de Sud
- L. Onea, T.A. Enache, E. Matei, M. Enculescu, M.I. Enculescu, Bio-Sensing properties of Single ZnO nanowire Field Effect Transistor, 72nd Annual Meeting of the International Society of Electrochemistry, 29.08.21 – 03.09.21, Jeju, Coreea de Sud
- Leote, C. Sanz, V. C. Diculescu, In-situ Evaluation of Shikonin Interaction with ds-DNA Electrochemical (poster), Biosensors73rd Annual Meeting of the International Society of Electrochemistry (Online) 12-16 September 2022
- Leote, C. Sanz, M.M. Barsan, V.C. Diculescu, Bienzymatic Biosensor for Pyruvate Kinase Inhibitors Screening for Cancer Treatment (oral), Biosystems in Toxicology and Pharmacology, Online, 8-9 September 2022
- Leote, C. Sanz, M.M. Barsan, A. Enache, V.C. Diculescu, Flexible Biosensors for Continuous Monitoring of Uric Acid in Sweat (oral), International Society of Electrochemistry Regional Meeting, Prague, Czech Republic 15-19 August 2022
- Leote, C. Sanz, M. M. Barsan, V. C. Diculescu, Bienzymatic biosensors for detection of pharmaceutical compounds (oral) 18th International Conference on Electroanalysis, ESEAC Vilnius, Lithuania 5-9 June 2022
- C. Diculescu, New Electrode Architectures Based on Electrospun Polymeric Fibers For (Bio)Sensing Applications (oral), 18th International Conference on Electroanalysis - ESEAC 2022, 5 - 9 Iunie 2022, Vilnius, Lituania
- Madalina Barsan, Caroline Sanz, Melania Onea, Victor Diculescu, Electrochemical investigations into protein degradation and inhibition (oral), The 6th edition of International Conference on Analytical and Nanoanalytical Methods for Biomedical and Environmental Sciences- IC-ANMBES 2022, 8 – 10 Iunie 2022, Brasov, Romania
- C. Diculescu, Catalytic degradation of proteins. Electrochemical biosensors for 20S proteasome activity and inhibition, The 13th International Symposium of the Romanian Catalysis Society, 22 – 24 iunie, Govora, Romania
Raportul științific Etapa 1
In cadrul acestei etape, conform planului de lucru, au fost desfășurate cinci activități de cercetare având ca obiective (i) fabricarea si caracterizarea de materiale nanostructurate pentru dezvoltarea de suprafețe modificate cu peptide amiloide, (ii) dezvoltarea de protocoale pentru prepararea de soluții de amiloide in diverse stadii de agregare, (iii) funcționalizarea suprafețelor nanostructurate cu peptide amiloide in vederea creșterii de celule neuronale pe aceste suprafețe, (iv) evaluarea electrochimica a elementului de sensing in vederea dezvoltării unui biosenzor pentru determinarea activității reductazei sulfoxidului de metionina (MsrA) si (v) Fabricarea de nanostructurilor catalitice necesare dezvoltării transductorului pentru biosenzorul dedicat determinării activității MsrA. Astfel, membrane comerciale polimerice au fost caracterizate, metalizate si testate in culturi celulare. De asemenea, au fost dezvoltate protocoale pentru prepararea de soluții de amiloida Abeta40 in diverse stadii de agregare si au fost evaluate din punct de vedere morfologic suprafețe modificate cu aceste peptide. Totodată, au fost caracterizate din punct de vedere electrochimic peptide sintetice conținând metionina si au fost fabricate fibre polimerice electrofilate metalizate si nanostructuri de oxid de zinc in vederea dezvoltării unui biosenzor pentru determinarea activității enzimei MsrA.
Toate obiectivele propuse au fost realizate iar rezultatele obținute au fost diseminate in cadrul a trei conferințe internaționale si un articol științific a fost trimis spre publicare in jurnalul Scientific Reports.
Raportul științific Etapa 2
In cadrul acestei etape, conform planului de lucru, au fost desfășurate sase activități de cercetare având ca obiective:
- fabricarea si caracterizarea de materiale nanostructurate;
- funcționalizarea suprafețelor nanostructurate cu peptide amiloid;
- testarea in vitro a suprafețelor modificate cu Abeta;
- fabricarea nanostructurilor catalitice necesare dezvoltării biosenzorului pentru MsrA;
- strategii pentru modificarea suprafeței electrodului și imobilizarea elementului senzitiv;
- evaluarea modificărilor chimice care apar la suprafața biosenzorilor.
Astfel, membrane comerciale polimerice au fost modificate cu rețele de fibre nanometrice biocompatibile, prin electrofilare, si testate folosind cultura de celule de melanom B16. De asemenea, au fost dezvoltate protocoale pentru modificarea de suprafețe cu fibrile Abeta dar si cu alte structuri proteice/peptidice cum ar fi colagen si polilisina iar biocompatibilitatea acestor suprafețe a fost verificată folosind linia celulara L929. Totodată, au fost fabricate si caracterizate din punct de vedere electrochimic si morfologic nanostructuri de oxid in vederea dezvoltării unui biosenzor pentru determinarea activității enzimei MsrA prin imobilizare la suprafața structurilor de oxid de zinc a unei peptide substrat pentru MsrA si evaluarea electrochimica a modificărilor de suprafața.
Toate obiectivele propuse au fost realizate iar rezultatele obținute au fost diseminate prin 7 prezentări in cadrul conferințelor internaționale si 4 articol științifice ce au fost publicate in reviste indexate ISI, in cuadrlile Q1 si Q2. De asemenea, rezultatele obținute in aceasta etapa au condus la elaborarea documentației pentru doua cereri de brevete naționale care au fost depuse la OSIM.
Raportul științific Etapa 3
In aceasta etapa au fost continuate activitatile de cercetare privind evaluarea culturilor celulare crescute pe suprafete modificate cu fibrile amiloide si dezvoltarea unui biosenzor pentru detectia enzimei reductaza a sulfoxidului de metionina (MsrA). Astfel, au fost efectuate urmatoarele activitati:
- Funcționalizarea suprafețelor nanostructurate cu peptide Abeta
- Testarea in vitro a suprafețelor modificate cu Abeta
- Strategii pentru modificarea suprafeței electrodului și imobilizarea elementului senzitiv
- Evaluarea modificărilor chimice care apar la suprafața biosenzorilor, optimizare și validare
In urma rezultatelor obtinute a fost evidentiat faptul ca fibrilele de amiloide nu prezinta toxicitate asupra culturilor celulare. De asemenea a fost dezvoltat si testat un biosenzor pentru MsrA dezvoltat pe electrozi de carbon serigrafiati si modificati cu structuri de oxid de zinc si o peptida substrat a MsrA.
Toate obiectivele propuse au fost atinse și rezultatele obținute au fost diseminate prin o prezentare la o conferințo internaționale și 2 articole științifice care au fost publicate în reviste indexate ISI, unul acceptat, si trei in evaluare.
Descrierea științifica si tehnica a rezultatelor
Pentru indeplinirea obiectivelor, proiectul a fost impartit in pachete de lucru (WP) si activitati (A).
WP1 Fabricarea suprafețelor nanostructurate și funcționalizarea cu peptide beta amiloid (Ab)
Activitate 1.1 Fabricare și caracterizare de materiale nanostructurate.
In cadrul acestei activități au fost fabricate, caracterizate din punct de vedere morfologic si testate in culturi celulare diverse materiale nanostructurate sub forma de substrat solid prin acoperiri metalice a lamelelor de microscop cu diametrul de 13 mm, Fig. 1.1 . De asemenea, au fost modificate prin metalizare, caracterizate si testate membrane polimerice comerciale DropSens (cat. Nr. MEMB) modificate ci fibre polimerice electrofilate, de dimensiuni nanometrice. După procesele de fabricare si caracterizare, materialele obținute fost supuse testelor de viabilitate/proliferare celulara folosind liniile de culturi celulare L929 sau B16. Astfel, au fost înregistrate imagini de microscopie de fluorescentă, folosind ca indicator acridin orange, si au fost realizate experimente de viabilitate prin utilizarea protocolului MTS, care are la baza transformarea sării de tetrazoliu MTS (3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium), sub acțiunea succinat-dehidrogenazei mitocondriale din celulele viabile, în formazan.

Fig. 1.1 Imagini SEM obținute la diferite magnificari pentru lamelele de sticla acoperite cu metale: A) Au; B) Ag si C) Pt
Din imaginile prezentate in Fig. 1.1 se poate observa faptul ca in urma depunerilor, pentru toate metalele alese, a rezultat formarea de filme metalice uniforme. Din punct de vedere al granulației filmele rezultate au arătat o granulație comparabila pentru Au si Pt însă pentru Ag a fost obținută o granulație mai mare. Este de așteptat ca aceste morfologii sa influențeze adsorbția agregatelor de amiloide sau adeziunea celulara, însă nu vor influenta dezvoltarea celulelor neuronale datorita dimensiunilor acestora.
In continuare, suprafețele de aur au fost testate in culturi celulare pentru investigarea biocompatibilitații acestui material. Astfel, lamelele de sticla acoperite cu aur au fost curățate cu alcool etilic in vederea decontaminării, uscate in hota microbiologica si însămânțate cu celule B16 iar pentru control au fost folosite suprafețe de sticla biocompatibile.
Rezultatele de microscopie de fluorescenta, Fig. 1.2, au demonstrat faptul ca pe ambele suprafețe celulele s-au dezvoltat optim având o morfologie tipica, cu nucleu bine definit si câteva prelungiri. Comparând rezultatele obținute s-a observat că suprafața de aur a prezentat o biocompatibilitate ridicată, evidențiată de numărul de celule și morfologia specifică, similar culturii celulare crescuta pe lama de sticlă.
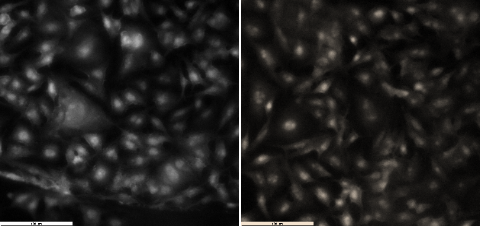
Fig. 1.2 Imagini de microscopie de fluorescenta obținute pentru celulele B16 crescute 48 h pe suprafețe de A) sticla biocompatibila si B) sticla metalizata cu aur; scala 100 µm.
Activitate 1.2 Protocoale pentru obținerea de fibrile Abeta
In vederea stabilirii condițiilor experimentale adecvate atât pentru obținerea de fibrile cat si pentru înțelegerea procesului de fibrilizare au fost dezvoltate/adaptate si testate diverse proceduri de preparare a soluțiilor. In urma analizelor spectrale ale tioflavinului T (ThT), folosit ca indicator fluorescent al agregării amiloidelor, au fost selectate si optimizate trei protocoale de lucru pentru preparare de soluții conținând monomeri, fibrile si placi de amiloide.
Primul pas al acestor protocoale consta in monomerizarea peptidei amiloid in stare liofilizata prin tratarea cu hexafluoroisopropanol (HFIP) iar după evaporarea solventului resuspensia peptidei amilod in DMSO la o concentrație maxima de 5 mM peptida. In continuare, in funcție de mediul apos folosit pot fi preparate soluții de amiloide in diverse stadii de agregare. Astfel, pentru o concentrație de 100 µM amiloida, va fi folosit ca mediu apos: i) H2O pentru monomer; ii) 1 mM HCl pentru fibrile si iii) 1Mm HCl + 150 Mm NaOH pentru placi de amiloide.
Pentru evidențierea stadiului de agregare, soluțiile de amiloide de concentrație 10 µM au fost incubate cu 10 µM ThT. Evaluarea stadiul de agregare a fost realizat prin măsurarea emisiei fluorescente corespunzătoare lungimii de unda de 490 nm rezultata in urma excitării la 450 nm. Rezultatele obținute sunt sumarizate in tabelul de mai jos.
Tabelul 1 Valorile emisiei fluorescente a ThT pentru lungimea de unda 490 nm obținute in urma excitarii la 450 nm
| ThT | Monomer | Fibrile | Placi | ||
| 0 h | 18 h | 0 h | 72 h | ||
| 0.35 104 | 1.27 104 | 2.27 104 | 8.66 103 | 1.4 104 | 9.8 103 |
Conform valorilor din Tabelul 1 a fost evidențiat faptul ca emisia fluorescentă ce corespunde ThT-ului legat de structurile peptidice fibrilare creste odată cu gradul de agregare, cele mai mari valori ale fluorescentei fiind obținute atât pentru fibrile cat si pentru plăcile de amiloide după 18, respectiv 72h incubare in soluție.
Activitate 1.3 Funcționalizarea suprafețelor nanostructurate cu peptide Abeta
In cadrul acestei activități suprafețele de aur au fost modificate cu amiloide Abeta40 folosind soluții proaspăt preparate, sau incubate timp de 24 de ore. Concentrația soluțiilor a fost de 10 µM monomer Abeta iar suprafețele obținute in urma modificărilor au fost evaluate prin microscopie de fluorescenta si electronica de baleiaj. Pentru microscopia de fluorescenta ThT a fost folosit ca indicator, acesta fiind adăugat probelor de amiloide la o concentrație de 10 µM, Fig. 1.3.
Dupa cum se poate observa in Fig. 1.3A, suprafețele modificate cu fibrile proaspăt preparate (0 h incubare) prezinta o acoperire uniforma fiind evidențiate fibrile micrometrice ce au tendința de a se constitui in agregate fibrilare largi, pe suprafața (Fig. 1.3A1). In schimb, pentru soluțiile de amiloide incubate 24 h in soluție, Fig. 1.3B, au fost observate fibrile mult mai groase, reduse ca număr si având lungimi de sute de micrometri. Aceste rezultate au arătat faptul ca in urma protocolului prezentat in Activitatea 1.2 se obțin fibrile scurte ce pot acoperi uniform suprafața dar care, in soluție, in timp, cresc continuu.
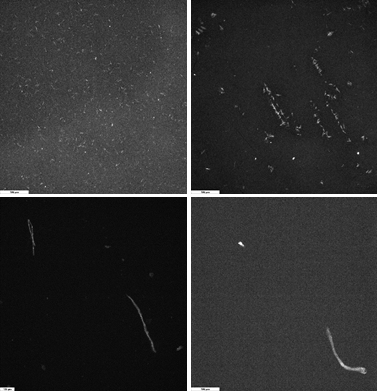
Fig. 1.3 Imagini de microscopie de fluorescentă obținute pentru fibrile de amiloide Abeta 40 depuse prin adsorbție libera timp de 10 min pe suprafețe de aur folosind soluții incubate A) 0 h si B) 24 h.
In concluzie, pentru activitățile etapelor următoare, ce presupun evaluarea celulelor neuronale crescute pe suprafețe modificate cu amiloide, vor fi folosite soluții de fibrile la 0 h.
WP2 Testarea in vitro a suprafețelor modificate cu Abeta
Activitate 2.1 Testarea in vitro a suprafețelor modificate cu Abeta
Suprafetele de sticla metalizata cu film subtire de aur au fost testate in vederea evaluarii biocompatibilitatii celulare folosind linia de fibroblaste L929. Pentru aceasta, lamelele metalizate (control) si cele modificate cu polilisina, collagen si fibrile Abeta au fost insamantate cu celule L929 la o densitate de 7000 celule / cm2 si lasate in incubator timp de 24 h in conditii controlate de umiditate, la 35 ℃ si 5% CO2. Dupa perioada de incubare au fost electuate teste de viabilitate celulara folosind protocolul MTS, Fig. 2.1. Rezultatele obtinute au confirmat o biocompatibilitate ridicata a suprafețelor, aceasta fiind cu câteva procente superioara controlului. Acest lucru poate explicat atât prin creșterea aderentei celulare cat si prin cresterea suprafeței active desfășurate a suprafețelor, obținuta in urma modificărilor.
Testele de viabilitate au fost extinse asupra altor tipuri de suprafete, i.e. sticla, sticla acoperita cu aur, sticle modificate cu amiloide, fibre polimerice de dimensiuni nanometrice, cu si fara modificari cu structuri amiloide Abeta sau de alta origine. Pentru aceste teste au fost folosite liniile celulare de fibroblaste L929 si neuroblastoma SH-sy5y. Efectul suprafetelor asupra dezvoltarii celulelor a fost facut prin investigatii de viabilitate si microscopie de florescenta si electronica de baleiaj.
Fig. 2.1 Viabilitatea celulara obtinuta pentru cultura L929 cultivata pe lamele metalizate cu aur si modificate cu polilisina, colagen si fibrile Abeta
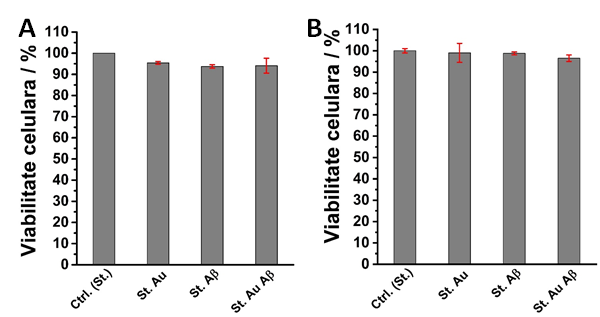
Fig. 2.2 Viabilitatea celulara obtinuta pentru liniile celulare A) L929 si B) SH-sy5y crescute pe diferite suprafete solide modificate cu fibrile de amiloide
Pentru cele doua linii celulare utilizate in cadrul acestui studiu au fost obtinute valori ale viabilitatii aproape de 100%, comparat cu controlul (sticla biocompatibila), atat pentru sticla modificata cu fibrile Abeta, cat si pentru sticlele metalizate cu aur si/sau modificate cu fibrile Abeta, Fig. 2.2.
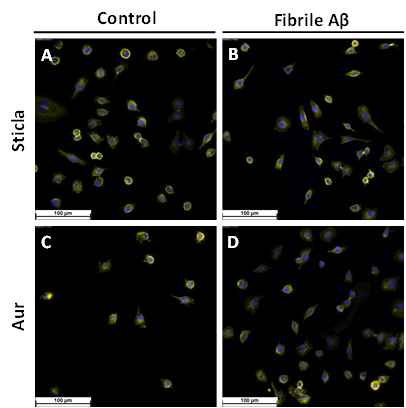
Fig. 2.3 Imagini de microscopie de fluoresceenta obtinute pentru L929 crescute pe diferite suprafete: A) St B) St Abeta C) Au D)AuAbeta
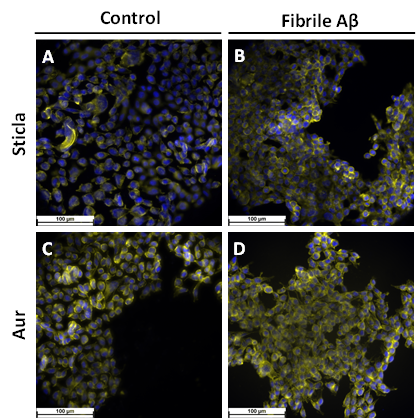
Fig. 2.4 Imagini de microscopie de fluoresceenta obtinute pentru SH-Sy5Y crescute pe diferite suprafete: A) Sticla B) sticla modificata cu fibrile Abeta C) Au D)Au modificat cu fibrile Abeta
Imaginile de microscopie de fluorescenta inregistrate pentru linia L929 insamantata pe diferite suprafete au confirmat studiile de viabilitate, celulele prezentand o distribuitie uniforma pe suprafata si morfologia specifica fibroblastelor, Fig. 2.3. Rezultate similare au fost obtinute si prin microscopia de fluorescenta, Fig. 2.4, si microscopia electronica de baleiaj, Fig. 2.5, pentru linia SH-SY5Y. Aceste studii dovedesc faptul ca pe suprafete solide fibrilele Abeta nu sunt toxice si nu induc efecte negative asupra celulelor.

Fig. 2.5 Imagini de microscopie electronica de baleiaj obtinute pentru SH-Sy5Y crescute pe diferite suprafete: A) Sticla B) sticla modificata cu fibrile Abeta C) Au D)Au modificat cu fibrile Abeta
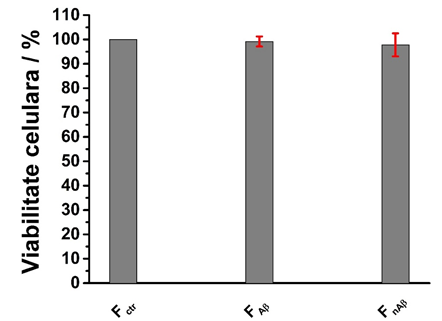
Fig. 2.6 Viabilitatea celulara obtinuta pentru linia celulara SH-sy5y crescuta pe diferite suporturi formate din nanofibre polimerice electrofilate si modificate cu fibrile de amiloid beta 42 si de origine nonamiloida (fragmentul 61-95 al peptidei α-synuclein)
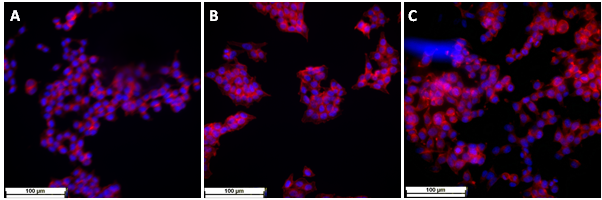
Fig. 2.7 Imagini de microscopie de fluoresceenta obtinute pentru SH-Sy5Y crescute pe diferite suprafete de fibre electrofilate: A) Fibre (control) B) Fibre modificate cu fibrile Abeta C) Fibre modificate cu fibrile nonAbeta

Fig. 2.8 Imagini de microscopie electronica de baleiaj obtinute pentru SH-Sy5Y crescute pe diferite suprafete de fibre electrofilate: A) Fibre (control) B) Fibre modificate cu fibrile Abeta C) Fibre modificate cu fibrile nonAbeta
De asemenea, efectul fibrilelor amiloide Abeta asupra liniiei neuronale, neuroblastoma SH-sy5y, a fost investigat folosind suprafete de fibre electrofilate de dimensiuni nanometrice prin studii de viabilitate, Fig. 2.6 si prin microscopie de fluorescenta, Fig. 2.7, si electronica de baleiaj, Fig. 2.8. Similar suprafetelor solide, a fost evidentiat faptul ca fibrilele de amiloide, atat de origine Abeta cat si de alta origine, nu induc neorotoxicitate. Pentru toate probele analizate, studiile de viabilitate si de microscopie de fluorescenta si electronica de baleiaj au aratat rezultate similare cu cele obtinute pentru experimentele control.
WP3 Dezvoltarea unui biosenzor pentru MsrA
Activitate 3.1 Elementul de sensing (bioreceptorul)
In cadrul acestei activitati au fost desfasurate studii electrochimice pentru a stabili modificarile chimice ce pot aparea la suprafata biosenzorului pentru MsrA. Astfel, folosind tehnica electrochimica de puls diferential si un electrod de carbon sticlos au fost investigate mecanismele de oxidare pentru un grup de peptide acetilate Glicinan-Metionina-Glicinan, unde n poate fi 1, 2 sau 3.
Voltamogramele inregistrate atat pentru peptida Ac-Gly-Met-Gly, Fig. 3.1, cat si pentru Ac-Gly-Gly-Gly-Met-Gly-Gly-Gly, Fig. 3.2 au aratat aparitia a doua picuri de oxidare avand un comporament electrochimic similar metioninei libere asociat cu formarea de sulfoxid de metionina, in jurul potentialului de + 1.0 V, si sulfona, la un potential mai pozitiv.
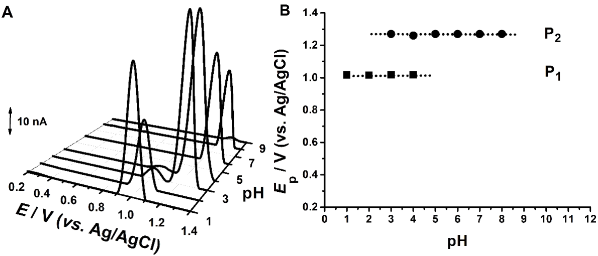
Fig. 3.1 (A) Voltamograme de puls diferential obtinute pentru 200 µM Ac-Gly-Met-Gly; (B) Ep vs. pH
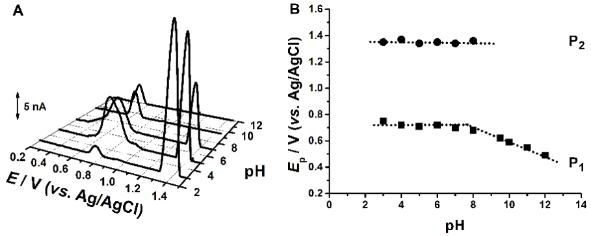
Fig. 3.2 (A) Voltamograme de puls diferențial obținute pentru 200 µM Ac-Gly-Gly-Gly-Met-Gly-Gly-Gly; (B) Ep vs. pH
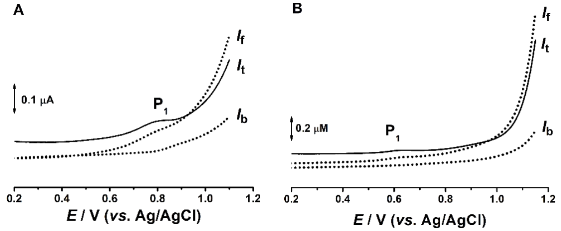
Fig. 3.3 Voltamograme de unda patrata obtinute pentru 200 µM Ac-Gly-Gly-Gly-Met-Gly-Gly-Gly in (A) pH = 7.0 si (B) pH = 11.0
Pentru peptida Ac-Gly-Gly-Gly-Met-Gly-Gly-Gly a fost observat faptul ca potentialul de oxidare corespunzator primei reactii anodice are loc la valori mai putin pozitive in comparatia cu secventele mai scurte, Fig. 3.2. Totodata, a fost observat faptul ca pentru valori de pH > 8, reactia de oxidare devine dependenta de pH ceea ce inseamna ca in reactia de oxidare sunt implicati protoni, Figura 3.2B. Mai mult, rezultatele de voltametrie de unda patrata, Fig. 3.3, au aratat ca, diferit de metionina liberea sau in cea din structura peptidelor continand doua sau patru residuri de glicina, prima dreactie de oxidare este reversibila pentru valori de pH < 7 si devine ireversibila la valori mai ridicate.
Activitate 3.2 Fabricarea nanostructurilor catalitice necesare dezvoltarii biosenzorului pentru MsrA
In urma diferitelor studii preliminare, in vederea fabricarii unor suprafete nanostructurate care sa faciliteze selectiv transductia reactiei de oxidare a reziduurilor de metionina au fost selectate nanostructuri de oxid de zinc.

Fig. 3.4 Depuneri de oxid de zinc efectuate la (A,C) -1 V (vs. Ag/AgCl) si (B, D) -0.9 V (vs. Ag/AgCl) folosind soluții de (A, B) 1 mM si (C, D) 5 mM
Pentru fabricarea structurilor de oxid de zinc a fost folosita metoda de depunerea electrochimică deoarece permite fabricarea nanostructurilor cu un control fin asupra proprietăților morfologice și structurale, acest control realizându-se prin reglarea parametrilor procesului de depunere. In cadrul acestei activități au fost depuse pe electrozi nanofire de ZnO dintr-o baie de nitrat de zinc, la o temperatura de 90 ℃. Au fost experimentate doua concentrații ale sării de zinc, de 1mM, respectiv, 5 mM. De asemenea, ajustarea parametrilor a fost făcută si prin modificarea tensiunii de depunere, fiind experimentate doua potențiale de depunere: -0.9 V si -1.0 V. Structurile astfel obținute au fost investigate prin SEM, Fig. 3.4. Analiza morfologica a evidențiat o distribuție uniforma pe întreaga suprafață de carbon a electrozilor serigrafiați a nanostructurilor de oxid de zinc, cu o forma aciculara si cu fațete bine definite, sub forma unor piramide pentagonale cu înălțimea de aproximativ 1 µm, Fig. 3.4. Imaginile SEM obținute au arătat o distribuție uniforma a structurilor de oxid de zinc pe întreaga suprafață de carbon a electrozilor serigrafiați. Structurile obținute au o forma aciculara cu fațete bine definite si se prezinta sub forma unor piramide pentagonale cu inaltimea de aproximativ 1 µm, Fig. 3.4. Conform acestor rezultate, parametrii depunerii electrochimice – 1.0 V/1 mM (Fig. 3.4 A) si -0.9 V/5 mM (Fig. 3.4D) au dus la cel mai ridicat grad de uniformitate.
Rezultatele voltametrice, Fig. 3.5 si 3.6, au aratat o stabilitate ridicata pentru intervalul de potential -1.0 V - + 1.4 V. Atat in voltametrie ciclica, cat si in puls diferential, se poate observa un profil voltametric specific carbonului modificat cu structuri catalitice. Aditional, in rezultatele de voltametrie ciclica, in regiunea catodica, a fost evidentiata prezenta oxigenului.
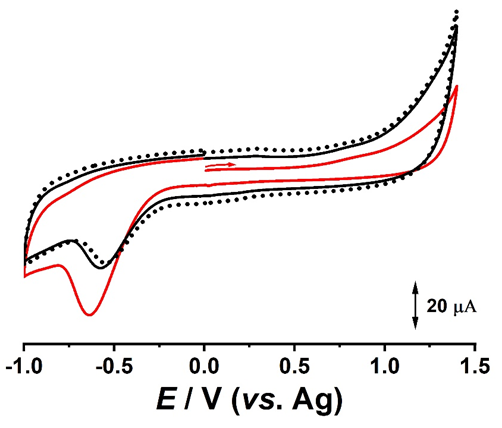
Fig. 3.5 Voltamograme ciclice înregistrate succesiv si obținute pentru electrodul DS modificat cu ZnO; (▬) prima, (▬) a doua si (···) a 5-a voltamograma.
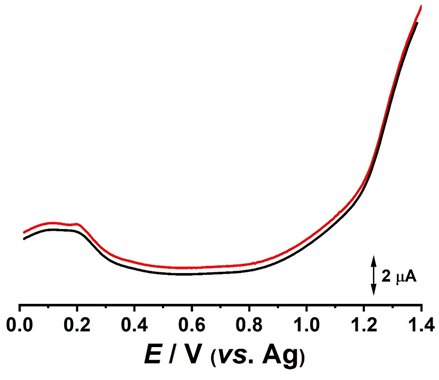
Fig. 3.6 Voltamograme de puls diferențial înregistrate succesiv si obținute pentru electrodul DS modificat cu ZnO; (▬) prima si (▬) a doua voltamograma
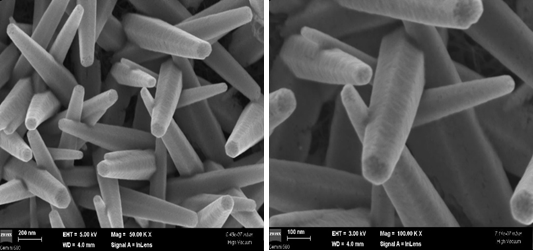
Fig. 3.7 Imagini de microscopie electronica de baleiaj obtinute pentru nanostructurile de ZnO crescute pe electrozii DS dupa experimentele voltametrice
Dupa efectuarea studiilor voltametrice suprafata electrodului de lucru a fost examinata din punct de vedere morfologic prin microscopie electronica de baleiaj, Fig. 3.7. Din imaginile obtinute se poate observa o usoara modificare a fatetelor nanostructurilor de oxid de zinc. Cu toate acestea, bazandu-ne pe rezultatele voltametrice, se poate afirma faptul ca pentru o analiza de 30 de minute, timp in care nanostructurile de oxid de zinc stau in contact cu solutii apoase si sub potential aplicat, electrozii obtinuti prezinta o stabilitate ridicata, asigurand o buna reproductibilitate.
Activitate 3.3 Strategii pentru modificarea suprafeței electrodului și imobilizarea elementului senzitiv
Au fost demarate studiile initiale pentru dezvoltarea unui biosenzor dedicat detectiei enzimei reductaza sulfoxidului de metionina, tipul A, (MsrA). Pentru aceasta au fost folosite substraturile de carbon modificate cu nanostructuri de oxid de zinc si o peptida acetilata, substrat al MsrA, compusa din sase reziduri de glicina si unul de sulfoxid de metionina, Ac-Gly-Gly-Gly-MetO-Gly-Gly-Gly (G3MOG3), Fig. 3.8.
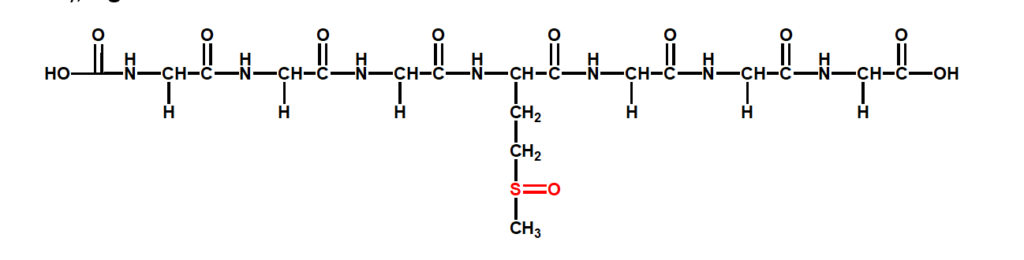
Fig. 3.8 Structura chimica a peptide Ac-Gly-Gly-Gly-MetO-Gly-Gly-Gly (G3MOG3)
Intr-o prima etapa, o peptida complementara, continand metionina, a fost imobilizata pe suprafata nannostructurilor de oxid de zinc prin adsorbție libera timp de 5, 10, 15 si 30 min folosind o solutii de concentratii cuprinse intre 100 si 1000 µM. Dupa imobilizare au fost inregistrate voltamograme de puls diferential si a fost evidentiata reactia de oxidare a metioninei. Comparand rezultatele, conditiile optime de imobilizare alese au fost adsorbtia timp de 15 min folosind o solutie de concentratie 500 µM.
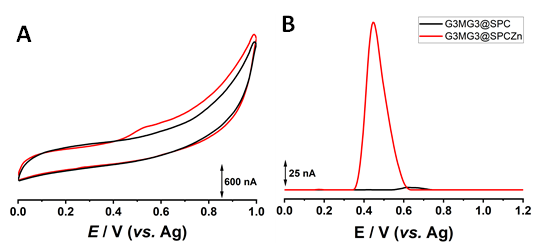
Fig. 3.9 Voltamograme A)ciclice si de B) impuls diferential obţinute pentru electrozi serigrafiati de carbon (──) (SPC) si ZNO/SPC (──) pe care a fost imobilizat de G3MG3.
Pentru verificarea semnalului electrochimic, la suprafata electrozilor de carbon si carbon modificat cuy structuro de oxid de zinc a fost imobilizata peptida conținând reziduul de metionina. Din voltamogramele inregistrate, Fig. 3.9, se poate observa avantajul adus de oxidul de zinc.
Activitate 3.4 Evaluarea modificărilor chimice care apar la suprafața biosenzorilor
In baza rezultatelor voltametrice prezentate in cadrul Activitatii 3.1 a fost posibil eleaborarea unui mecanism de oxidare elecrtochimica pentru peptida Ac-Gly-Gly-Gly-Met-Gly-Gly-Gly.
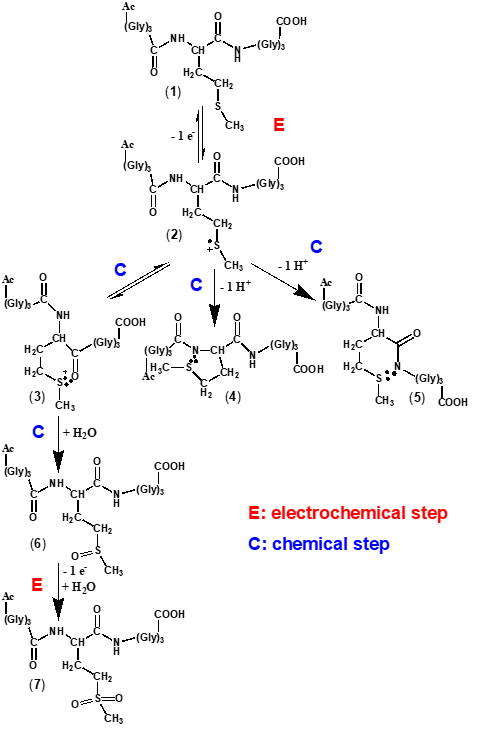
Fig. 3.10 Mecanismul de electro-oxidare al peptidei Ac-Gly-Gly-Gly-Met-Gly-Gly-Gly propus pentru pH = 7.0.
Conform mecanismului propus, Fig. 3.10, prima etapă corespunde transferului electrochimic de un electron de la atomul de sulf al reziduului de metionină (1) și formării unui radical cation de sulf mono-omeric (2), stabilizat prin suportul catalitic al gruparilor vecine, carbonil si aminda, din lantul peptidic, speciile (3), (4), si (5). Pentru electroliții acizi și neutri, prin stabilizare, cationul radical se transformă în specia S.·.O (3) între sulf și gruparea carbonil a scheletului peptidic, Schema 2, o specie care poate fi inversat electrochimic în metionină, așa cum a confirmat experimentele de voltametrie de unda patrata. Totuși, dacă scanarea voltametrică continuă, reacția nu este inversată și are loc oxidarea speciei (3) in sulfoxid de metionina (6) si în sulfonă (7), la potențiale mai pozitive.
Pentru electroliți cu valori de pH > 7, cationul radical (2) se transformă rapid într-o specie S.·.N (4) și (5) cu pierderea unui proton, așa cum a fost observat in urma rezultatelor de voltametrie de puls diferential.
In cea de-a doua etapa ce a presupus imobilizarea peptidei de interes G3MOG3 si fabricarea biosenzorului. Principiul de functionare este bazat pe proprietatile enzimei MsrA de a reduce sulfoxidul de metionina al peptidei imobilizate. In urma reactiei enzimatice peptida imobilizata va deveni electroactiva si va permite evidentiarea ratei de reactie enzimatica. Asa cum era de asteptat, in urma incubarii cu diferite concentratii de enzima MsrA, s-a observat aparitia si cresterea semnalului electrochimic corespunzator residuurilor de metionina, Fig. 3.11.
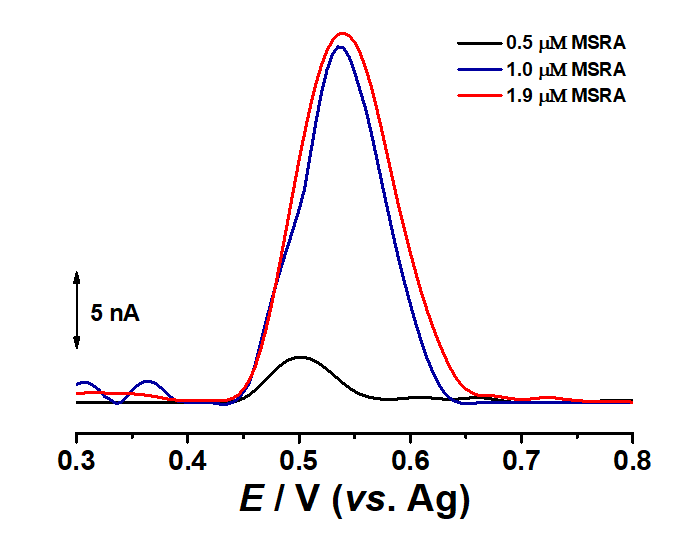
Fig. 3.11 Voltamograme de puls diferential obtinute cu biosenzorul pentru MsrA dupa 5 min incubare cu diferite concentratii de MsrA
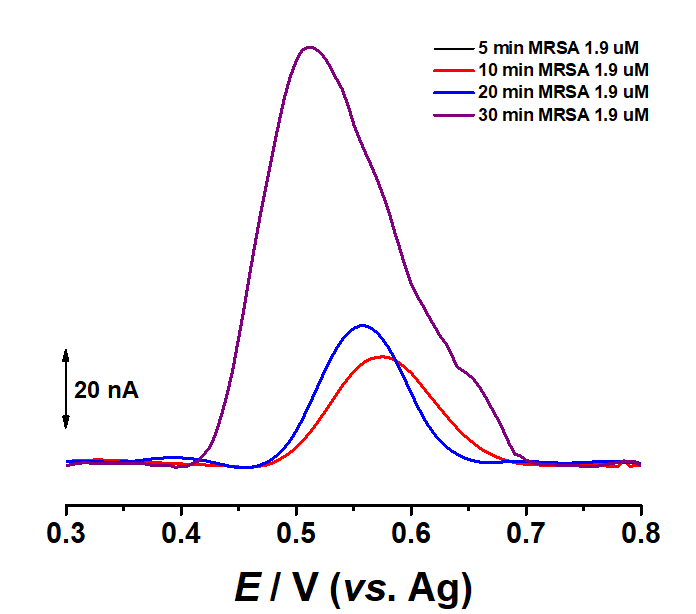
Fig. 3.12 Voltamograme de puls diferential obtinute cu biosenzorul pentru MsrA dupa incubarea timp de 10, 20 si 30 min cu 1.9 µM MsrA
De asemenea, prin mentinerea concentratiei de enzima si varierea timpului de incubare, a fost evidentiat faptul ca rata de reactie este direct proportionala cu timpul de incubare, dupa cum se poate observa in Fig. 3.12.
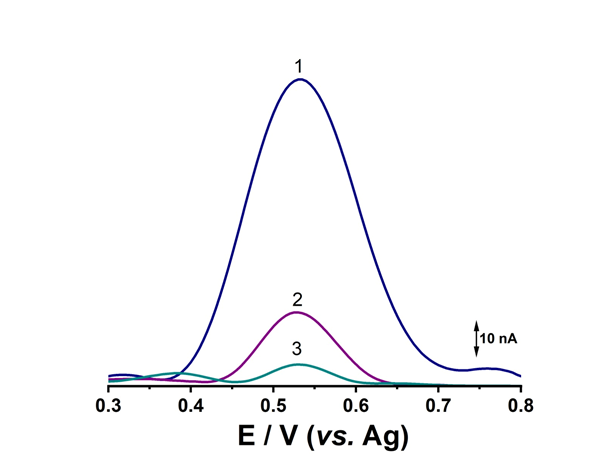
Fig. 3.13 Voltamograme în puls diferenţial obtinute cu biosenzorul pe baza de G3M(O)G3 pentru MsrA dupa incubarea la diferiti timpi 0h, 24h si 48h cu 1 µM MsrA in pH=7.00 .
Avand in vedere ca dupa masurarea electrochimica a biosenzorului, datorita potentialului aplicat, reziduurile de metionina vor exista in forma oxidata, in ultima parte a acestei activitati a fost investigat procesul de regenerare al biosenzorului. Astfel, dupa o prima utilizare, biosenzorul a fost spalat cu tampon fosfat si incubat din nou, Fig. 3.13 Rezultatul obtinut a aratat o scadere a semnalului cu pana la 70% iar dupa a treia utilizare raspunsul biosenzorului a fost sub 10%, ceea ce demonstreaza faptul ca biosenzori sunt de uz unic, insa pretul redus de fabricare (~ 8.00 – 8.50 EUR) face ca acest lucru sa nu fie un impediment.
Livrabile
| Propuse | Realizate |
| Suprafete nanostructurate | Sticle metalizate, fibre polimerice de dimensiuni nanometrice cu si fara metalizari |
| Protocoale pentru prepararea de fibrile Aβ | 3 protocoale |
| Suprafete nanostructurate modificate cu fibrile Aβ | Sticle metalizate, fibre polimerice de dimensiuni nanometrice cu si fara metalizari |
| Teste de biocompatibilitate | > 6 studii de viabilitate |
| Elementul de recunoastere pentru MsrA | Peptide cu diverse lungimi continand sulfoxid de metionina ca element de biorecunoastere |
| Suprafete catalitice pentru transductie | Electrozi de carbon serigrafiati modificati cu oxid de zinc |
| Biosenzor pentru MsrA | Un biosenzor |
| 4 articole stiintifice ISI | 6 articole publicate, 3 in evaluare, unul in redactare |
| 2 cereri de brevete | 2 cereri de brevet, una in elaborate |
Impact
Proiectul a fost dedicate în special cercetării fundamentale și aplicate care se ocupă cu dezvoltarea de noi biomateriale funcționale, bazandu-se pe funcționalizarea suprafețelor nanostructurate cu peptide Aβ pentru imbunatatirea proceselor de adeziune si proliferare celulara, precum și dezvoltarii unui biosenzor electrochimic pentru detectarea precoce a bolii Alzheimer. Înțelegerea proceselor de agregare și adsorbție a peptidelor Aβ la suprafețele solide nanostructurate poate duce la dezvoltarea unei noi clase de biomateriale funcționale. Amiloidele, avand o structură ordonată, pot oferi functionalitati de suprafață/interfață si pot duce la devoltarea de aplicatii biomedicale. Biocompatibilitate, adeziunea celulara si proliferarea celulelor neuronale pe suprafete conductoare modificate cu astfel de peptide, demonstatate in cadrul acestui proiect, prezintă un potențial mare de aplicații în biotehnologia și biomaterialele de generație următoare, cu implicatii in gestionarea a diverse maladii neurodegenerative, cum ar fi Alzheimer sau Parkinson.
Dezvoltarea de biosenzori pentru evaluarea unui biomarker potențial asociat dezvoltării bolii Alzheimer în stadiul incipient al bolii are potențialul de a produce dispozitive biotehnologice ieftine, care să fie utilizate în managementul bolii, oferind o fereastră substanțială de timp pentru a interveni în progresia bolii.Utilizarea si modificarea suprafetelor electrozilor comerciali, serigrafiati, de unic uz, prezinta avantajul major al miniaturizarii crescând astfel mobilitatea sistemelor analitice. Rezultatele obtinute in cadrul acestui proiect pune bazele unor viitoare aplicatii experimental-demontrative ce pot duce la dezvoltarea de dispositive analitice dedicate îmbunătățirii calității vieții pentru noi toți.
PROJECTS/ PROIECTE NATIONALE
Copyright © 2024 National Institute of Materials Physics. All Rights Reserved